Meitnerio
El meitnerio es un elemento químico de la tabla periódica cuyo símbolo es Mt y su número atómico es 109. Es un elemento sintético cuyo isótopo más estable es el 278Mt, cuya vida media es de 7,6 s.
| Hasio ← Meitnerio → Darmstatio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Meitnerio, Mt, 109 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 9, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 268 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d7 7s2 (predicción)[1][2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel |
2, 8, 18, 32, 32, 15, 2 (predicción) (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Desconocida | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 129 (estimado)[3] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3, 4, 6[4] (suposición basada en el iridio) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Probablemente sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del meitnerio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Introducción
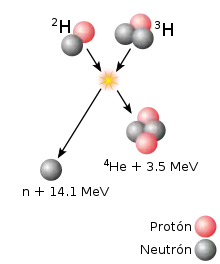
En la física nuclear, un elemento se llama pesado si su número atómico es alto; el plomo (elemento 82) es un ejemplo de tal elemento pesado. El término "elementos superpesados" suele referirse a los elementos con número atómico superior a (Lawrencio 103) (aunque hay otras definiciones, como número atómico superior a 100[5] o 112;[6][7] a veces, el término se presenta como un equivalente al término "transactínido", que pone un límite superior al comienzo de la hipotética serie superactínidos). [8] Los términos "isótopos pesados" (de un elemento dado) y "núcleos pesados" significan lo que podría entenderse en el lenguaje común: isótopos de alta masa (para el elemento dado) y núcleos de alta masa, respectivamente.
Los núcleos de los átomos se crean en reacciones nucleares que combinan otros dos núcleos de tamaños diferentes. En el 2009, un grupo del JINR dirigido por Oganessian publicó resultados de su intento por crear Hasio mediante la reacción simétrica 136Xe + 136Xe. No lograron observar ni un solo átomo en tal reacción, poniendo el límite superior de la sección eficaz, la medida de la probabilidad de una reacción nuclear, en 2.5 picobarn.[9] A modo de comparación, la reacción mediante la cual se descubrió el hasio, 208Pb + 58Fe, tiene una sección eficaz de unos 20 pb (específicamente, 19+19
−11 pb), según estimaron sus descubridores. [10]
En general cuanto más desiguales sean los dos núcleos en términos de masa, mayor será la posibilidad de que ambos reaccionen.[11] El material formado por los núcleos más pesados se convierte en un blanco, que luego es bombardeado por el haz de núcleos más ligeros. Dos núcleos sólo pueden fusionarse en uno si se acercan lo suficiente; normalmente, los núcleos (todos con carga positiva) se repelen debido a la repulsión electrostática. La interacción fuerte puede exceder esta repulsión pero solo dentro de distancias muy cortas del núcleo; por ellos los núcleos de un haz son muy acelerados de forma tal de que dicha fuerza de repulsión sea insignificantye comparada con la velocidad del haz de núcleos. [12] El acercamiento por si solo no es suficiente para que dos núcleos se fusionen: cuando dos núcleos se acercan, suelen permanecer juntos por unos 10−20 segundos y luego se separan (no necesariamente en la misma composición que tenían antes de la reacción) en vez de formar un núcleo único. [12][13] Si no se produce fusión, el núcleo compuesto temporario es un estado excitado. Para desprenderse de la energía de excitación y alcanzar un estado más estable, un núcleo compuesto se fisiona o eyecxta uno o varios neutrones, (cuanto mator es la energía de excitación, más neutrones son eyectados. Si la energía de excitación es menor que la energía de acoplamiento de cada neutrón con el resto del núcleo, no se emiten neutrones; en cambio, el núcleo compuesto disminuye su nivel de energía emitiendo un rayo gama.[14]) que se llevan la energía. Ello occurre en aproximadamente unos 10−16 segundos luego de la colisión inicial.[14] La definición del Grupo de Trabajo de la IUPAC/IUPAP establece que un elemento químico solo puede ser reconocido si un núcleo del mismo no ha decaido en un lapso de por lo menos 10−14 segundos. Este valor se eligió como una estimación del tiempo que tarda un núcleo en adquirir sus electrones exteriores y, por tanto, mostrar sus propiedades químicas.[15]Esta cifra también marca el límite superior generalmente aceptado para la vida de un núcleo compuesto.[16]
El haz pasa a través del blanco y llega a la siguiente cámara, el separador; si se produce un nuevo núcleo, se lleva con este haz.[17] En el separador, el núcleo recién producido se separa de otros núclidos (el del haz original y cualquier otro producto de la reacción). Esta separación se basa en que los núcleos resultantes se mueven por el blanco más lentamente que los núcleos del haz sin reaccionar. El separador contiene campos eléctricos y magnéticos cuyos efectos sobre una partícula en movimiento se anulan para una velocidad específica de una partícula.[18] Esta separación puede ser puede ser incentivada mediante una medición de tiempo de vuelo y energía de retroceso; una combinación de las dos formas que permiten estimar la masa de un núcleo, [19] y transferido a un detector de barrera superficial, que frena el núcleo. Se marca la ubicación exacta del impacto en el detector; como también su energía y el tiempo para su llegada.[17] La transferencia puede demandar unos 10−6 segundos; de forma que pueda ser detectada, el núcleo debe poder sobrevivir por lo menos este tiempo.[20] El núcleo queda registrado nuevamente al producirse su decaimiento, y su ubicación, la energía, y el tiempo de decaimiento es medido.[17]
La estabilidad de un núcleo es provista por la interacción fuerte. Sin embargo, su alcance es muy reducido; en la medida que los núcleos son más grandes, su influencia sobre los nucleones más externos (protones y neutrones) se debilita. Simultáneamente, sobre el núcleo actúa la fuerza de repulsión electroestática entre protones, que posee un alcance ilimitado.[21] Los núcleos de los elementos más pesados por lo tanto se predice teóricamente[22] y hasta ahora se ha observado[23] que se desintegran principalmente a través de modos de desintegración que son causados por dicha repulsión: desintegración alfa y fisión espontánea; (No todos los modos de desintegración son causados por la repulsión electrostática. Por ejemplo, la desintegración beta es causada por la interacción débil.[24]) estos modos son predominantes para los núcleos de elementos superpesados. Las desintegraciones alfa se registran por las partículas alfa emitidas, y los productos de la desintegración son fáciles de determinar antes de la desintegración real; si tal desintegración o una serie de desintegraciones consecutivas produce un núcleo conocido, el producto original de una reacción puede determinarse aritméticamente. Como la masa de un núcleo no se mide directamente, sino que se calcula a partir de la de otro núcleo, tal medición se llama indirecta. Las mediciones directas también son posibles, pero en su mayor parte no han estado disponibles para los núcleos más pesados.[25] En 2018 se informó de la primera medición directa de la masa de un núcleo superpesado en el LBNL.[26] La masa se determinó a partir de la ubicación de un núcleo después de la transferencia (la ubicación ayuda a determinar su trayectoria, que está vinculada a la relación masa-carga del núcleo, ya que la transferencia se realizó en presencia de un imán).[27].
La fisión espontánea, sin embargo, produce varios núcleos como productos, por lo que no se puede determinar el nucleido original a partir de sus hijas. (La fisión espontánea fue descubierta por el físico soviético Georgy Flerov,[28] un destacado científico del JINR, por lo que fue un "caballo de batalla" para la instalación. [29] En cambio, los científicos del LBL creían que la información sobre la fisión no era suficiente para afirmar la síntesis de un elemento. Creían que la fisión espontánea no se había estudiado lo suficiente como para utilizarla en la identificación de un nuevo elemento, ya que existía la dificultad de establecer que un núcleo compuesto sólo había expulsado neutrones y no partículas cargadas como protones o partículas alfa.[16] Así pues, prefirieron vincular los nuevos isótopos a los ya conocidos mediante desintegraciones alfa sucesivas.[28])
La información de que disponen los físicos que pretenden sintetizar uno de los elementos más pesados es, pues, la que se recoge en los detectores: localización, energía y tiempo de llegada de una partícula al detector, y las de su desintegración. Los físicos analizan estos datos y tratan de concluir que, efectivamente, ha sido causada por un nuevo elemento y que no ha podido ser causada por un nucleido diferente al que se afirma. A menudo, los datos proporcionados son insuficientes para concluir que se creó definitivamente un nuevo elemento y que no hay otra explicación para los efectos observados; se han cometido errores en la interpretación de los datos. Por ejemplo, el elemento 102 fue identificado por error en 1957 en el Instituto Nobel de Física de Estocolmo, Condado de Estocolmo, Suecia.[30] No hubo afirmaciones definitivas anteriores sobre la creación de este elemento, y sus descubridores suecos, estadounidenses y británicos le asignaron un nombre, nobelio. Posteriormente se demostró que la identificación era incorrecta.[31] Al año siguiente, el LBNL fue incapaz de reproducir los resultados suecos y anunció en su lugar su síntesis del elemento; esa afirmación también fue desmentida posteriormente.[31] El JINR insistió en que eran los primeros en crear el elemento y sugirió un nombre propio para el nuevo elemento, joliotium;[32] el nombre soviético tampoco fue aceptado (el JINR se refirió posteriormente a la denominación del elemento 102 como "precipitada"). [33] El nombre "nobelio" no se modificó debido a su uso generalizado.[34]
Historia
El meitnerio fue sintetizado por primera vez el 29 de agosto de 1982 por Peter Armbruster y Gottfried Münzenberg en el Instituto de Investigación de iones Pesados (Gesellschaft für Schwerionenforschung) en Darmstadt.[35]
El equipo lo consiguió bombardeando bismuto-209 con núcleos acelerados de hierro-58. La creación de este elemento demostró que las técnicas de fusión nuclear podían ser usadas para crear nuevos núcleos pesados.
El nombre de meitnerio fue sugerido en honor a la matemática y física, de origen austríaco y sueco, Lise Meitner,[36] pero había una controversia acerca de los nombres de los elementos comprendidos entre 101 y 109; así pues, la IUPAC adoptó el nombre de unnilennio (símbolo Une) de manera temporal, como nombre sistemático del elemento. En 1997, decidieron la disputa y adoptaron el nombre actual.
Referencias
- Hoffman, D; Lee, D; Pershina, V (2006). «Transactinides and the future elements». En Morss; Edelstein, N; Fuger, J, eds. The Chemistry of the Actinide and Transactinide Elements (en inglés) (Tercera edición). Dordrecht: Springer Science+Business Media. ISBN 978-1-4020-3555-5. OCLC 1113045368.
- Thierfelder, C; Schwerdtfeger, P; Heßberger, F; Hofmann, S (2008). «Dirac-Hartree-Fock studies of X-ray transitions in meitnerium». The European Physical Journal A (en inglés) (Les Ulis: Springer) 36 (2): 227. Bibcode:2008EPJA...36..227T. ISSN 1434-6001. OCLC 4670641182. doi:10.1140/epja/i2008-10584-7.
- Chemical Data. Meitnerium - Mt, Royal Chemical Society
- HaireMorss, Edelstein, Fuger (2006). «Transactinides and the future elements». The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer Science+Business Media. p. 1674. ISBN 1-4020-3555-1.
- Krämer, K. (2016). article «Explainer: superheavy elements». Chemistry World. Consultado el 15 de marzo de 2020.
- A. Wakhle, ,C. Simenel, Hinde D. J. Masgupta=M., Evers M., Luong D.H., du Rietz R. (2015). «Comparación de distribuciones de ángulos de masa de cuasifisión experimentales y teóricas». European Physical Journal Web of Conferences 86: 00061. Bibcode:2015EPJWC..8600061W. ISSN 2100-014X. doi:10.1051/epjconf/20158600061.
- «Discovery of Elements 113 and 115». Lawrence Livermore National Laboratory. Archivado desde llnl. gov/research-and-development/nuclear-science/project-highlights/livermorium/elements-113-and-115 el original el 11 de septiembre de 2015. Consultado el 15 de marzo de 2020.
- Scott R. A. (2018). «Estructura electrónica de los átomos transactínidos». Enciclopedia de Química Inorgánica y Bioinorgánica. John Wiley & Sons. pp. 1-16. ISBN 978-1-119-95143-8. doi:10.1002/9781119951438.eibc2632.
- Oganessian, Yu. Ts.; Dmitriev, S. N.; Yeremin, A. V. et al. (2009). «Attempt to produce the isotopes of element 108 in the fusion reaction 136Xe + 136Xe». Physical Review C 79 (2): 024608. ISSN 0556-2813. doi:10.1103/PhysRevC.79.024608.
- Münzenberg, G.; Armbruster, P.; Folger, H.; Heßberger, F. P.; Hofmann, S.; Keller, J.; Poppensieker, K.; Reisdorf, W.; Schmidt, K.- H.; Schött, H.-J.; Leino, M. E.; Hingmann, R. (1984). «La identificación del elemento 108». Zeitschrift für Physik A 317 (2): 235-236. Bibcode:..235M 1984ZPhyA.317 ..235M. doi:10.1007/BF01421260. Archivado desde el original el 7 de junio de 2015. Consultado el 20 de octubre de 2012.
- Subramanian, S. (2019). «Hacer nuevos elementos no es rentable. Just Ask This Berkeley Scientist». Bloomberg Businessweek. Archivado desde el original el 14 de noviembre de 2020. Consultado el 18 de enero de 2020.
- Ivanov, D. (2019). «Сверхтяжелые шаги в неизвестное» [Superheavy steps into the unknown]. N+1 (en ruso). Consultado el 2 de febrero de 2020.
- Hinde, D. (2014). «Something new and superheavy at the periodic table». The Conversation. Consultado el 30 de enero de 2020.
- Krása, A. (2010). «Neutron Sources for ADS». Czech Technical University in Prague. pp. 4-8. Archivado desde el original el 3 de marzo de 2019. Consultado el October 20, 2019.
- Wapstra, A. H. (1991). pdf «Criterios que deben cumplirse para que se reconozca el descubrimiento de un nuevo elemento químico». Pure and Applied Chemistry 63 (6): 883. ISSN 1365-3075. doi:10.1351/pac199163060879. Consultado el 28 de agosto de 2020.
- Hyde, E. K.; Hoffman, D. C.; Keller, O. L. (1987). «Una historia y un análisis del descubrimiento de los elementos 104 y 105». Radiochimica Acta 42 (2): 67-68. ISSN 2193-3405.
- Chemistry World (2016). com/article/how-to-make-superheavy-elements-and-finish-the-periodic-table-video/ «Cómo hacer elementos superpesados y terminar la tabla periódica [vídeo]». Scientific American. Consultado el 27 de enero de 2020.
- Hoffman, Ghiorso y Seaborg, 2000, p. 334.
- Hoffman, Ghiorso y Seaborg, 2000, p. 335.
- Zagrebaev, Karpov y Greiner, 2013.
- Beiser, 2003, p. 432.
- Staszczak, A.; Baran, A.; Nazarewicz, W. (2013). «Modos de fisión espontáneos y tiempos de vida de elementos superpesados en la teoría del funcional de la densidad nuclear». Physical Review C 87 (2): 024320-1. Bibcode:2013PhRvC..87b4320S. ISSN 0556-2813. arXiv:1208.1215. doi:10.1103/physrevc.87.024320.
- Audi et al., 2017, pp. 030001-128-030001-138.
- Beiser, 2003, p. 439.
- Oganessian, Yu. Ts.; Rykaczewski, K. P. (2015). «Una cabeza de playa en la isla de la estabilidad». Physics Today 68 (8): 32-38. Bibcode:2015PhT....68h..32O. ISSN 0031-9228. OSTI 1337838. doi:10.1063/PT.3.2880.
- Grant, A. (2018). «Pesando los elementos más pesados». Physics Today. doi:10.1063/PT.6.1.20181113a.
- Howes, L. (2019). org/physical-chemistry/periodic-table/IYPT-Exploring-the-superheavy-elements-at-the-end-of-the-periodic-table/97/i21 «Explorando los elementos superpesados al final de la tabla periódica». Chemical & Engineering News. Consultado el 27 de enero de 2020.
- Robinson, A. E. (2019). «Las guerras del transfermio: peleas científicas e insultos durante la Guerra Fría». Distillations. Consultado el 22 de febrero de 2020.
- «Biblioteca popular de elementos químicos. Seaborgio (eka-tungsteno)». n-t.ru (en ruso). Consultado el 7 de enero de 2020. Reimpreso de Biblioteca popular de elementos químicos. Silver through nielsbohrium and beyond, chapter=Eka-tungsteno (en ruso). Nauka. 1977.
- «Nobelio - Información sobre el elemento, propiedades y usos | Tabla Periódica». Royal Society of Chemistry. Consultado el 1 de marzo de 2020.
- Kragh, 2018, pp. 38-39.
- Kragh, 2018, p. 40.
- Ghiorso, A.; Seaborg, G. T.; Oganessian, Yu. Ts.; Zvara, I; Armbruster, P; Hessberger, F. P; Hofmann, S; Leino, M; Munzenberg, G; Reisdorf, W; Schmidt, K.- H (1993). «Responses on the report 'Discovery of the Transfermium elements' followed by reply to the responses by Transfermium Working Group». Pure and Applied Chemistry 65 (8): 1815-1824. doi:10.1351/pac199365081815. Archivado desde el original el 25 de noviembre de 2013. Consultado el 7 de septiembre de 2016.
- Commission on Nomenclature of Inorganic Chemistry (1997). «Nombres y símbolos de los elementos de transferencia (Recomendaciones de la IUPAC 1997)». Pure and Applied Chemistry 69 (12): 2471-2474. doi:10.1351/pac199769122471.
- «Elementos Químicos». herramientas.educa.madrid.org. Consultado el 28 de agosto de 2022.
- «Por qué el meitnerio, un extraño elemento químico descubierto hace 35 años, "hace justicia" a un error histórico de los Nobel». BBC News Mundo. Consultado el 28 de agosto de 2022.
Bibliografía
- Audi, G.; Kondev, F. G.; Wang, M. et al. (2017). «The NUBASE2016 evaluation of nuclear properties». Chinese Physics C 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- Beiser, A. (2003). Concepts of modern physics (6th edición). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418.
- Hoffman, D. C.; Ghiorso, A.; Seaborg, G. T. (2000). The Transuranium People: The Inside Story. World Scientific. ISBN 978-1-78-326244-1.
- Kragh, H. (2018). From Transuranic to Superheavy Elements: A Story of Dispute and Creation. Springer. ISBN 978-3-319-75813-8.
- Zagrebaev, V.; Karpov, A.; Greiner, W. (2013). «Future of superheavy element research: Which nuclei could be synthesized within the next few years?». Journal of Physics: Conference Series 420 (1): 012001. Bibcode:2013JPhCS.420a2001Z. ISSN 1742-6588. S2CID 55434734. arXiv:1207.5700. doi:10.1088/1742-6596/420/1/012001.