Hexametilentetramina
La hexametilentetramina es un compuesto orgánico heterocíclico cuya fórmula es (CH2)6N4. También es conocida como hexamina, metenamina, urotropina, formamina, HMTA y hexaformo.[2]
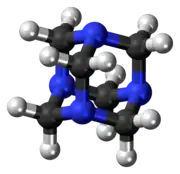
Posee una estructura de jaula simétrica tetraédrica. Es similar a la del adamantano, cuyos cuatro «vértices» son átomos de nitrógeno y las «aristas» son grupos metileno. Si bien la forma molecular define una jaula, no existe espacio libre en su interior para alojar otros átomos o moléculas.
Este compuesto fue descubierto por el químico ruso Aleksandr Butlerov en 1859.[3][4][5]
| Hexametilentetramina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,3,5,7-tetraazatriciclo[3.3.1.13,7]decano | ||
| General | ||
| Otros nombres |
Hexamina Metenamina Urotropina 1,3,5,7-Tetraazaadamantano Urodeína Formamina Hexaformo HMTA | |
| Fórmula molecular | C6H12N4 | |
| Identificadores | ||
| Número CAS | 100-97-0[1] | |
| Número RTECS | MN4725000 | |
| ChEMBL | CHEMBL1201270 | |
| ChemSpider | 3959 | |
| DrugBank | 06799 | |
| PubChem | 4101 | |
| UNII | J50OIX95QV | |
| KEGG | D00393 | |
|
C1N2CN3CN1CN(C2)C3
| ||
| Propiedades físicas | ||
| Apariencia | Sólido. Cristales o polvo blanco. | |
| Olor | Inodoro | |
| Densidad | 1331 kg/m³; 1,331 g/cm³ | |
| Masa molar | 140,19 g/mol | |
| Punto de ebullición | 280 °C (553 K) | |
| Presión de vapor | 4 × 10-3 mmHg | |
| Índice de refracción (nD) | 1,731 | |
| Propiedades químicas | ||
| Acidez | 5,1 pKa | |
| Solubilidad en agua | 895 g/L (20 ºC) | |
| Solubilidad | 80 g/L (en etanol) | |
| log P | -2,84 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 523,15 K (250 °C) | |
| Temperatura de autoignición | 553,15 K (280 °C) | |
| Compuestos relacionados | ||
| aminas y diaminas |
1-hexanamina Ciclohexanamina 1,6-hexanodiamina Tetrametiletilendiamina | |
| tetraminas |
Trietilentetramina Tris(2-aminoetil)amina | |
| aminas heterocíclicas |
Piperidina Piperazina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, la hexametilentetramina es un sólido con una densidad de 1,331 g/L. Su aspecto es el de polvo o cristales de color blanco prácticamente inodoros; los cristales formados en alcohol son rómbicos. Sublima cuando se calienta a 280 °C, siendo su vapor 4,9 veces más denso que el aire. Es muy soluble en agua —en torno a 895 g/L—[6] y también soluble en etanol y acetona. El valor del logaritmo de su coeficiente de reparto, logP = -2,84, indica que su solubilidad es notablemente mayor en disolventes polares que en apolares; así, es sólo ligeramente soluble en éter etílico y prácticamente insoluble en éter de petróleo.[2]
La hexametilentetramina es una sustancia higroscópica.[7] El valor de su pKa es igual a 5,13[8] y se descompone cuando es tratada con ácidos fuertes o ácidos orgánicos concentrados.[2] Es también incompatible con oxidantes fuertes, reaccionando violentamente con peróxido de sodio. A más de 90 °C reacciona de forma explosiva con el 1-bromopentaborano(9). Es, además, corrosiva para algunos metales como aluminio y zinc.[9]
Síntesis
La hexametilentetramina se prepara haciendo reaccionar formaldehído y amoníaco,[10] reacción que puede tener lugar en fase gaseosa y en disolución:

Otra vía para sintetizar esta poliamina es por N-desnitración de una nitroamina —como octógeno (HMX)— por una dihidronicotinamida.[11] Relacionada con la anterior síntesis es la reducción controlada de ciclotrimetilentrinitramina (RDX), sustancia extremadamente explosiva, que también produce hexametilentetramina.[12]
Usos
Usos históricos
En medicina, la hexametilentetramina se usó por primera vez en 1899 como antiséptico urinario.[13] Solo se empleó en casos de orina ácida, siendo utilizado el ácido bórico en el caso de infecciones de tracto urinario con orina alcalina.[14] Se observó que la eficacia de esta tetramina dependía enormemente de la acidez de la orina, más que de la cantidad de medicamento administrado; de hecho, en condiciones alcalinas, la hexametilentetramina es casi completamente inactiva.[14]
Durante la Primera Guerra Mundial, la hexametilentetramina también se empleó para tratar a soldados expuestos a fosgeno. Estudios posteriores han demostrado que dosis elevadas de hexametilentetramina proporcionan cierta protección si se toma antes de la exposición, pero ninguna si se administra a posteriori.[15]
Usos industriales
El principal uso de la hexametilentetramina radica en la producción de preparaciones —en polvo o líquidas— de resinas fenólicas, donde se añade como componente para dar resistencia. Estos productos se usan como ligantes, por ejemplo en revestimientos de frenos y embragues, en productos abrasivos, en ciertos tejidos y en materiales ignífugos.[10]
Junto al 1,3,5-trioxano, la hexametilentetramina es un componente de pastillas de combustible usadas por campistas u organizaciones militares para calentar comida. Al arder no desprende humo y tampoco deja cenizas residuales, además de tener una alta densidad energética (30,0 MJ/kg).
Esta poliamina también ha sido empleada como conservante en la industria alimentaria (como INS 239). Está autorizado su uso en la Unión Europea[16] con la denominación E239 E, si bien no lo está en países como Estados Unidos, Rusia, Australia o Nueva Zelanda.[17]
Por otra parte, la hexametilentetramina es un reactivo versátil en la síntesis orgánica.[18] Se emplea en la reacción de Duff (formilación de anillos aromáticos activados),[19] en la reacción de Sommelet (conversión de haluros bencénicos en aldehídos)[20] y en la reacción de Delepine (síntesis de aminas a partir de haluros de alquilo).[21]
Asimismo, es un componente básico en la producción de explosivos como RDX, C-4,[10] octógeno, dinitrato de hexamina y HMTD.
Usos en medicina
La hexametilentetramina se usa como sal del ácido mandélico —mandelato de metenamina—[22] para tratar infecciones del tracto urinario. La hexametilentetramina se descompone a pH 5,5 o inferior, formándose amoníaco y formaldehído, teniendo este último actividad bactericida. La acidez de la orina se asegura administrando vitamina C (ácido ascórbico) o cloruro de amonio. Aunque su utilización como medicamento se había reducido a finales de los años 1990 debido a efectos adversos —cistitis hemorrágica por sobredosis—,[23] su uso se ha aprobado nuevamente por el aumento de la resistencia a los antibióticos habitualmente empleados. Este fármaco está particularmente indicado para el tratamiento profiláctico a largo plazo de la infección del tracto urinario, dado que las bacterias no desarrollan resistencia al formaldehído. En un estudio de no inferioridad, randomizado, multicéntrico y sin ciego publicado en marzo del 2022 en la revista The BMJ se observó que la hexametilentetramina resultó no inferior en relación al uso de terapia antimicrobiana en relación a la prevención de infecciones urinarias [24]
Véase también
Los compuestos siguientes poseen la estructura del adamantano con uno, dos o tres átomos de nitrógeno:
- 1-azatriciclo[3.3.1.13,7]decano
- 1,3-diazadamantano
- 1,3,5-triazadamantano
Las siguientes aminas derivan de hidrocarburos bicíclicos:
- Quinuclidina
- Trietilendiamina (DABCO)
- 7-azanorbornano
- 2-azabiciclo(2.2.1)heptano
Referencias
- Número CAS
- Hexamethylenetetramine (PubChem)
- Butlerow, A. (1859). «Ueber einige Derivate des Jodmethylens» [Sobre algunos derivados del ioduro de metileno]. Ann. Chem. Pharm. (en alemán) 111 (2): 242-252. doi:10.1002/jlac.18591110219.
- «Copia archivada». Archivado desde el original el 6 de febrero de 2009. Consultado el 20 de junio de 2016.
- Butlerow, A. (1860). «Ueber ein neues Methylenderivat» [Sobre un nuevo derivado de metileno]. Ann. Chem. Pharm. (en alemán) 115 (3): 322-327. doi:10.1002/jlac.18601150325.
- hexamethylenetetramine (Molbase)
- Hexamine (ChemSpider)
- pKa Data Compiled by R. Williams
- Hexamethylenetetramine(100-97-0) (Chemical Book)
- Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi 10.1002/14356007.a02_001
- Robert D. Chapman, Richard A. O'Brien, Paul A. Kondracki (1996). «N-denitration of nitramines by dihydronicotinamides». Tetrahedron 52 (29): 9655-9664. Consultado el 21 de junio de 2016.
- Callum J. McHugh, W. Ewen Smith, Richard Laceyb, Duncan Graham (2002). «The first controlled reduction of the high explosive RDX». Chemical Communications 2002 (21): 2514-2515. Consultado el 21 de junio de 2016.
- Heathcote, Reginald St. A. (1935). «HEXAMINE AS AN URINARY ANTISEPTIC: I. ITS RATE OF HYDROLYSIS AT DIFFERENT HYDROGEN ION CONCENTRATIONS. II. ITS ANTISEPTIC POWER AGAINST VARIOUS BACTERIA IN URINE». British Journal of Urology 7 (1): 9-32. ISSN 0007-1331. doi:10.1111/j.1464-410X.1935.tb11265.x.
- Elliot (1913). «On Urinary Antiseptics». British Medical Journal 98: 685-686.
- Diller, Werner F. (1980). «The methenamine misunderstanding in the therapy of phosgene poisoning (review article)». Archives of Toxicology 46 (3-4): 199-206. ISSN 0340-5761. doi:10.1007/BF00310435.
- UK Food Standards Agency: «Current EU approved additives and their E Numbers». Consultado el 27 de octubre de 2011.
- Australia New Zealand Food Standards Code«Standard 1.2.4 - Labelling of ingredients». Consultado el 27 de octubre de 2011.
- Blažzević, N.; Kolbah, D.; Belin, B.; Šunjić, V.; Kajfež, F. (1979). «Hexamethylenetetramine, A Versatile Reagent in Organic Synthesis». Synthesis 1979 (3): 161-176. doi:10.1055/s-1979-28602.
- Allen, C. F. H.; Leubne, G. W. (1951). "Syringic Aldehyde". Org. Synth. 31: 92.
- Wiberg, K. B. (1963). "2-Thiophenaldehyde". Org. Synth.; Coll. Vol. 3: 811.
- Bottini, A. T.; Dev, V.; Klinck, J. (1963). "2-Bromoallylamine". Org. Synth. 43: 6.
- «Methenamine mandelate, USP». Edenbridge Pharmaceuticals. Archivado desde el original el 17 de mayo de 2017. Consultado el 22 de junio de 2016.
- Ross, R. R.; Conway, G. F. (1970). «Hemorrhagic cystitis following accidental overdose of methenamine mandelate». Am. J. Dis. Child. 119 (1): 86-87. PMID 5410299. doi:10.1001/archpedi.1970.02100050088021.
- https://www.bmj.com/content/376/bmj-2021-0068229