Propileno
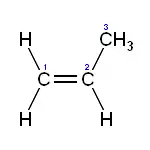
El propileno o propeno (H2C=CH–CH3) es un hidrocarburo perteneciente a los alquenos, incoloro y con un débil olor similar al del petróleo, prácticamente inodoro.[2]Es un homólogo del etileno. Como todos los alquenos presenta el doble enlace como grupo funcional. Es el segundo compuesto más utilizado en la industria química en todo el mundo.[3]
| Propileno | ||
|---|---|---|
 | ||
 Modelo molecular tridimensional | ||
| Nombre IUPAC | ||
| Propeno | ||
| General | ||
| Otros nombres |
Propileno Metiletileno Metileteno | |
| Fórmula semidesarrollada | H2C=CH–CH3 | |
| Fórmula molecular | C3H6 | |
| Identificadores | ||
| Número CAS | 115-07-1[1] | |
| Número RTECS | UC6740000 | |
| ChEBI | 16052 | |
| ChEMBL | CHEMBL117213 | |
| ChemSpider | 7954 | |
| PubChem | 8252 | |
| UNII | AUG1H506LY | |
| KEGG | C11505 | |
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,81 kg/m³; 1,83 g/cm³ | |
| Masa molar | 42.08 g/mol | |
| Punto de fusión | 88,3 K (−185 °C) | |
| Punto de ebullición | 225 K (−48 °C) | |
| Punto de descomposición | 342 K (69 °C) | |
| Presión crítica | 24.07 atm | |
| Presión de vapor | 1020 kPa (a 20 °C) | |
| Peligrosidad | ||
| SGA |
 | |
| Punto de inflamabilidad | 165 K (−108 °C) | |
| NFPA 704 |
4
1
1
| |
| Temperatura de autoignición | 733 K (460 °C) | |
| Frases R | R12 | |
| Frases S | S9 S16 S33 | |
| Límites de explosividad | 2,0 - 11,1% de propeno en el aire. (a 20 °C) | |
| Riesgos | ||
| Riesgos principales | Inflamable | |
| Más información | Concentración máxima permitida en los lugares de trabajo: 500 ppm (VLA-ED, ACGIH-2008). | |
| Compuestos relacionados | ||
| Alquenos | Etileno, Isómeros de Butileno | |
| Otros compuestos relacionados | Propano, 2-Propanol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
El propeno es uno de los productos de la termólisis del petróleo. Se separa de los demás productos como el etileno por destilación a baja temperatura.
Aplicaciones
El propeno es el producto de partida en la síntesis del polipropileno.
La adición de agua en condiciones polares da iso-propanol que puede ser oxidado a la acetona. En condiciones radicalarias se obtiene n-propanol.
El ácido acrílico se produce actualmente utilizando el proceso de oxidación selectiva del propeno en dos etapas. El propeno es también un compuesto intermedio en la oxidación selectiva en una etapa de propano a ácido acrílico. Este último proceso se investiga intensivamente porque el propano es significativamente más barato en comparación con el propeno.[4][5][6][7]
Reacciones
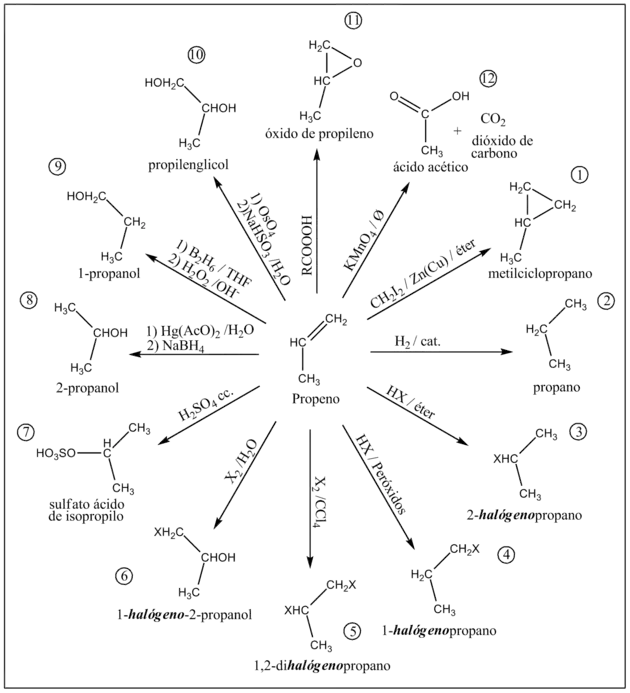
1) Reacción de Simmons-Smith
El diyodometano en una aleación de zinc y cobre forma el carbenoide yoduro de yodometil zinc (CH2IZnI).[8] Mediante un mecanismo de cicloadición se adiciona un grupo metilo al propeno produciéndose el metilciclopropano (como mezcla racémica R y S). La reacción ocurre con buenos rendimientos.[8]
2) Hidrogenación
El propeno en presencias hidrógeno y de un catalizador (comúnmente Pd/C o PtO2 llamado catalizador de Adams) se reduce completamente a propano.[8] La adición electrofílica ocurre con estereoquímica syn.[8]
3) Hidrohalogenación
La hidrohalogenación ocurre al hacer burbujear un halogenuro de hidrógeno en un recipiente conteniendo propeno en éter.[8] Como producto principal de la reacción se obtendrá el 2-halógenopropano (P.Ej: utilizando HBr se obtiene el 2-bromopropano).
4) Hidrohalogenación en presencia de peróxidos
Cuando la hidrohalogenación del propeno ocurre el presencia de peróxidos la regioselectividad de la reacción se invierte dando como principal producto el 1-halógenopropano (P.Ej: utilizadando HCl se obtiene el 1-cloropropano).[8]
5) Halogenación
Al hace reaccionar el propeno con un halógeno en tetraclorometano como solvente se produce el 1,2-dihalógenopropano (P.Ej: utilizando I2 se obtiene el 1,2-diyodopropano).[8]
6) Formación de halohidrinas
Cuando la halogenación se produce en presencia de agua se produce el 1-halógeno-2-propanol (P.Ej: utilizando Br2 como halógeno se produce el 1-bromo-2-propanol).[8]
7) Adición de ácido sulfúrico
El ácido sulfúrico concentrado se adiciona al propeno por un mecanismo de adición electrofílica produciendo el sulfato ácido de isopropilo.
8) Obtención de alcoholes por oximercuración
Al tratarse con acetato de mercurio (II) en tetrahidrofurano (THF) y agua y posteriormente con borohidruro de sodio (NaBH4) se produce el 2-propanol con alto rendimiento.[8]
9) Hidroboración
Mediante el tratamiento con diborano y posterior hidrólisis oxidativa con peróxido de hidrógeno (H2O2) el medio alcalino se obtiene el alcohol Antimarkovnikov 1-propanol.[8]
10) Dihidroxilación syn
La oxidación con tetróxido de osmio (OsO4) seguido del tratamiento con bisulfito de sodio y agua produce propilenglicol (como mezcla racémica R y S).[8] También se producirá la reacción de dihidroxilación syn utilizando KMnO4 diluido en medio acuoso básico a baja temperatura.[8]
11) Obtención de epóxidos
La peroxidación del propeno con un peroxiácido (RCO3H) a temperatura ambiente produce el óxido de propileno (como mezcla racémica R y S) mediante la reacción de Prileschajew.[9][10]
Industrialmente se produce por oxidación con oxígeno en presencia de un catalizador de óxido de plata (Ag2O) a altas temperaturas (300 °C).[9]
12) Clivaje oxidativo
La oxidación violenta del propeno con KMnO4 caliente produce por clivaje oxidativo ácido acético y dióxido de carbono.[8] También se obtendrían los mismos productos por ozonólisis con ozono (O3) a bajas temperaturas (-78 °C) y posterior clivaje oxidativo con peróxido de hidrógeno (H2O2) en medio alcalino.[8]
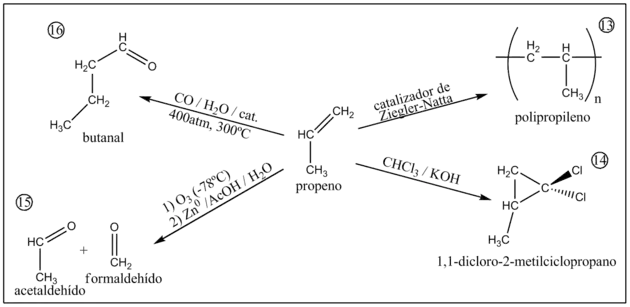
13) Polimerización
La polimerización del propileno a polipropileno se puede llevar a cabo de forma radicalaria aunque en la polimerización catalítica se obtienen productos con mejores calidades que además son mejor controlables. Los catalizadores empleados eran originalmente del tipo Ziegler-Natta. En la actualidad se están sustituyendo por otros sistemas basados en zirconocenos.
14) Adición de diclorocarbeno
Al tratar el propeno con cloroformo y con una base fuerte como KOH se obtiene 1,1-dicloro-2-metilciclopropano (como mezcla racémica R y S).[8]
15) Ozonólisis con clivaje reductivo
Por Ozonólisis con posterior clivaje oxidativo se obtiene como productos formaldehído y acetaldehído.[8]
16) Hidroformilación
La hidroformilación del propeno con monóxido de carbono, agua y un catalizador de Co a altas presiones y temperaturas produce butanal como principal producto.[11]
Información adicional
- N.º ICSC: 0559
- N.º CE: 601-011-00-9
N.º de índice (clasificación y etiquetado armonizados conforme al Reglamento CLP (en:CLP_Regulation) de la UE)
Referencias
- Número CAS
- U.S. National Library of Medicine, National Center for Biotechnology Information (8 de diciembre de 2019). «Propylene compound summary» [Propileno resumen de compuesto] (en inglés). Consultado el 12 de diciembre de 2019.
- «Propylene Production from Methanol». by Intratec, ISBN 978-0-615-64811-8.
- «The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts». Journal of Catalysis 311: 369-385. 2014. doi:10.1016/j.jcat.2013.12.008. Archivado desde el original el 15 de febrero de 2016.
- Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (en inglés). 2011.
- «Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid». Journal of Catalysis 285: 48-60. 2012. doi:10.1016/j.jcat.2011.09.012. Archivado desde el original el 30 de octubre de 2016.
- «Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol». ACS Catalysis 3 (6): 1103-1113. 2013. doi:10.1021/cs400010q.
- McMurry, John (2004). «Alquenos: reacciones y síntesis». Química Orgánica (sexta edición). Thompson. pp. 208-237. ISBN 970-686-354-0.
- McMurry, John (2004). «Éteres y epóxidos. tioles y sulfuros». Química Orgánica (sexta edición). Thompson. pp. 648-649. ISBN 970-686-354-0.
- Beyer, Walter (1987). «Compuestos alinfáticos». Manual de química orgánica (19º edición). Reverté. p. 79. ISBN 84-291-7066-9.
- Yúfera, Eduardo Primo (1996). «Hidrocarburos III. Alquenos». Química orgánica básica y aplicada:de la molécula a la industria (Volumen 1). Reveté. pp. 158-159. ISBN 84-291-7953-4.
Enlaces externos
- https://www.ilo.org/dyn/icsc/showcard.display?p_lang=es&p_card_id=0559 Ficha ICSC del propileno en el sitio web de la Organización Internacional del Trabajo
