Blastema
El blastema es una masa de células desdiferenciadas, encargadas de procesos de proliferación celular y rediferenciación de nuevas estructuras, perdidas por posibles daños mecánicos (amputaciones) durante el proceso de regeneración epimorfica.[1]
La creación del blastema depende de la formación de células mononucleadas individuales,[1] y a su vez requiere de factores tróficos (factores de crecimiento), derivados a partir del capuchón apical ectodérmico (AEC) y de la epidermis de la herida (WE), y a su vez de la presencia de nervios capaces de inervar el blastema, con el fin de garantizar su supervivencia y proliferación.[2]
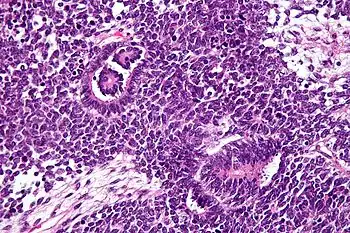
Las imágenes muestran las características de tres componentes: la pequeña y redonda maligno (azul), las células ~ 2 veces el tamaño de los linfocitos en reposo (componente de blastema); las estructuras tubulares o rosetas (componente epitelial) y estroma suelta paucicelular con células fusiformes.
Formación
La formación del blastema es un paso imperativo en el proceso de regeneración epimórfica, ya que este tipo de regeneración cuenta con una secuencia específica en la cual primero ocurre la amputación de la extremidad, luego la formación del blastema, la proliferación, y finalmente la diferenciación de la estructura totalmente regenerada.[3] Durante los primeros días de la amputación, los tejidos cercanos a la herida empiezan un proceso de desorganización, en el cual las células ubicadas en la periferia comienzan a migrar bajo la herida de la epidermis (WE), acumulándose en el centro del muñón.[3]
La herida de la epidermis (WE), estructura conformada por una sola capa celular, es necesaria para la regeneración de la estructura, y prolifera para formar el capuchón apical ectodérmico. Cuando las células se acumulan en el centro del muñón, empiezan a dar origen a las células del blastema, que eventualmente formarán la estructura regenerada.[3]
El proceso por el cual se originan las células del blastema se conoce clásicamente como desdiferenciación. La desdiferenciación hace referencia a un proceso mediante el cual una célula somática es capaz de recuperar las capacidades de multiplicación y diferenciación en un grado celular cualquiera, mediante el uso de distintos factores de transcripción, incrementando así su potencialidad.[4] La desdiferenciación involucra una serie de procesos específicos seriales, que conllevan las células durante el proceso de formación del blastema. Esta serie empieza con una degradación de la matriz extracelular, que faculta una liberación celular que permite que las células del muñón sean capaces de volver a entrar en el ciclo celular, con una pérdida progresiva de la especialización fenotípica característica del tipo celular. Después se da un cambio en el patrón de actividad genética, con el fin de reemplazar la matriz extracelular adulta con una más emparentada con la estructura dañada.[4]
Degradación de la matriz extracelular
Las matriz extracelular es degradada mediante hidrolasas ácidas como la cathepsina D, ácido phosphatoso, β-glucoronidasa, hidrolasas de ester carboxílico y metaloproteinasas de matriz (MMPs). Se ha observado una expresión elevada de MMPs durante la formación del blastema. Las hidrolasas ácidas mencionadas son liberadas a partir de células con heridas causadas por daños mecánicos o células en estadios últimos de vida agonizantes. Estas enzimas presentan una actividad elevada, principalmente en condroclastos y osteoclastos, los cuales cumplen con la función de degradar el cartílago y el tejido óseo, y a su vez presentan una abundancia relativamente alta en estructuras durante procesos de regeneración. En el caso de los MMPs, el origen de estas proteasas aún no está muy claro, debido a que los patrones espaciales de expresión no han sido profundamente estudiados, y por ende se desconoce qué tipos celulares son los encargados de liberar las sustancias. Sin embargo, es probable que los macrófagos liberados hacia la zona de la herida secreten las MMPs que digieren las matrices extracelulares, manteniendo juntas a las células epiteliales. Otros posibles candidatos para desempeñar esta tarea son los neuritos que se van extendiendo al blastema, e incluso se ha planteado la posibilidad de que las células del propio blastema sean las encargadas de secretar las proteasas.[4]
Durante la embriogénesis, los neuritos en expansión se abren paso a través de la matriz extracelular mediante la excreción de MMPs. Los macrófagos, de igual forma, liberan MMPs para digerir la matriz extracelular, desorganizada en tejidos afectados, e inclusive las células de la epidermis tienen la capacidad de secretar MMPs, con el fin de cortar coágulos de plasma durante la re-epitelializacion de una herida.[4] La degradación de la matriz concluye con la diferenciación y morfogénesis de las células de blastema y la sintetizacion de la matriz extracelular, acompañada de forma paralela con la presencia de factores inhibitorios de las MMPs.[4]
Reingreso de mionucleos al ciclo celular
El reingreso al ciclo celular acompañado de la pérdida de la especialización fenotípica, solo ha sido documentado a partir de estudios de células musculares (mioblastos) en salamandras. El reingreso de núcleos de mioblastos al ciclo celular está mediado por inductores como el suero o distintos factores de crecimiento derivados del suero, que actúan como mitógenos. Estos factores de crecimiento estimulan la fosforilación de la proteína del retinoblastoma, de la cual emergen factores de transcripción E2F, que posteriormente activan los genes cuyos productos son esenciales para la síntesis de ADN. Sin embargo, se ha encontrado que los mismos factores de crecimiento que estimulan la síntesis de ADN en el caso de los mioblastos, fallan cuando estimulan la síntesis en los miotubos. Estos resultados indican que a medida que los mioblastos se van diferenciando, los miotubos paran su respuesta a la acción de los distintos factores de crecimiento, pero expresan un receptor capaz de responder al estímulo de otra proteína del suero para la síntesis de ADN.[4]
La proteína encargada de la estimulación de los miotubos aún no ha sido identificada, pero estudios que emplean fracciones tanto de miotubos como de mioblastos cultivados, sugieren que la presencia de trombina es requerida para la activación de los miotubos. Experimentos flurogenicos han mostrado incrementos en la tasa de actividad de la trombina cuando el blastema se encuentra en fase de formación.[4]
Los miotubos multinucleados, tras ser liberados del ciclo celular, ingresan en el blastema y dan origen a células mononucleadas proliferantes, capaces de diferenciarse en un amplio rango de tejidos presentes en la estructura en regeneración. El mecanismo mediante el cual los núcleos de los miotubos son inducidos al reingreso del ciclo celular, se da mediante un factor proveniente del suero creado por la trombina. La trombina, que a su vez es la misma proteasa involucrada en la formación de coágulos, es liberada durante lesiones mecánicas de los tejidos. Esta liberación se da de forma paralela a la aparición del suero en la herida, y cuando ambas sustancias entran en contacto, se crea un factor capaz de inducir a los miotubos a reingresar en el ciclo celular.[4]
Este factor de inducción causado por la trombina no parece ser un factor global entre las especies. En estudios realizados con miotubos de ratón, se observó que los núcleos de estas células no respondían a la acción de esta proteína, pero sí se desdiferenciaban en presencia del blastema de la salamandra durante el proceso de regeneración. Por ello, se pudo concluir que la diferencia en la respuesta podía estar relacionada con la capacidad regenerativa entre salamandras y mamíferos.[1]
Pérdida de la especialización fenotípica
La pérdida de la especialización fenotípica se da por medio de mecanismos poco conocidos. Sin embargo, se cree que puede estar relacionado con el proceso de degradación de la matriz extracelular. La degradación de dicha matriz se realiza por medio de proteasas específicas, que su a vez anulan el contacto entre las moléculas ubicadas en la matriz y los receptores de integrina, causando cambios en la morfología de los tipos celulares, y reorganizando la actina presente en el citoesqueleto. Esta reorganización puede activar rutas de transducción de señales que inducen a la regulación de enzimas, que desmantelan estructuras internas de cada fenotípico específico celular.[4]
Las rutas mediante las cuales se da la activación no han sido claramente estipuladas, pero se sabe de la existencia de ciertos genes cuyos productos están relacionados con la iniciación o el mantenimiento del proceso de disferenciación. Uno de estos productos ampliamente conocido en es el factor de transcripción MSX1, expresado en el muñón o en el proceso de formación del blastema. En estudios en los cuales se expresaba ectópicamente este factor de transcripción, se observó una clara inhibición en el proceso de miogenesis, mediante la regulación del gen para MyoD. Sin embargo, la expresión de MSX1 solo se da hasta el estado cónico de formación del blastema.[4]
Otros genes posiblemente relacionados con el proceso de disferenciacion son Nrad, radical fringe, y notch. En el caso de Nrad, se ha observado que presenta una regulación en los núcleos de las miofibras durante las primeras 4 horas posteriores a un daño en el tejido. El rfrng es expresado en procesos de regeneración únicamente en las células presentes en el blastema, y también es el encargado de activar una cascada de notch en otros procesos de desarrollo. Teniendo en cuenta que esta ruta es característica de las células embrionicas y las células madres en estadios de no diferenciación y estadios de proliferación, existe un alto grado de relación en la iniciación o el mantenimiento de la desdiferenciación celular. Adicionalmente, estos genes pueden regular la expresión de la matriz extracelular sintetizada por las células de blastema, lo cual ayudaría en el proceso de desdiferenciación.[5]
Origen de las células del blastema
Estudios efectuados con microscopio electrónico y de luz indican que las células del blastema se originan posiblemente mediante la desdiferenciación de mioblastos, fibroblastos dérmicos, tejido conectivo y células de Schawnn. Estas células progenitoras se encuentran ubicadas a pocos milímetros del plano de la herida donde se producirá el proceso de regeneración. Por tanto, se puede inferir que el proceso de regeneración no puede ser llevado a cabo por células circulantes de zonas distantes a la zona de amputación, o por células madre activadas en una locación distante al sitio de amputación. Además, a partir de estudios de amputación de extremidades en salamandras, se conoce que las células progenitoras tienen la capacidad de persistir, inclusive en estructuras que ya fueron previamente regeneradas, lo que demuestra que las células progenitoras se renuevan en las estructuras maduras de los individuos.[3]
Existen dos tipos de población de células de blastema. La primera es equivalente a las células mesenquimales no diferenciadas en la región distal de muñón, cuya función está relacionada con el crecimiento y el patrón de formación. Durante el desarrollo de una extremidad, esta población se encuentra ubicada en una región denominada 'región de progreso'. La segunda población consiste en tipos celulares que poseen patrones de migración hacia la estructura durante su regeneración. Esta migración se encuentra mediada por señales posicionales provistas por células de la primera población. Estas poblaciones de células cuentan con papeles activos durante el desarrollo de las extremidades. Las células de la primera población son conocidas por contribuir con la formación de tejidos conectivos y esqueléticos, mientras que las células de la segunda población son precursoras de vasos sanguíneos, mioblastos y fibras nerviosas.[6]
A pesar de la certeza de que ciertas células progenitoras son capaces de derivar de células de blastema, el origen de éstas era ampliamente desconocido. La evidencia encontrada en estudios de regeneración de extremidades de salamandras, apuntaba a que todos los tejidos de la extremidad madura contribuían con células que sufrían procesos de diferenciacion para la formación del blastema, y posteriormente a la regeneración completa de la estructura perdida. Sin embargo, una nueva evidencia encontrada a partir de estudios realizados con injertos de tejidos previamente marcados, indica que la participación de los tipos celulares presenta una jerarquía y no un comportamiento equitativo en el proceso de formación del blastema.[3]
La contribución celular al blastema se indica a continuación.
Nervios y vasos sanguíneos
La estructura regenerada contiene tanto nervios como vasos sanguíneos, que presentan continuidad con más estructuras proximales en el muñón. Anteriormente se pensaba que el blastema temprano disponía de poca vascularización, con vasos sanguíneos creciendo distalmente en estadios más desarrollados derivados de vasos preexistentes en el muñón. Sin embargo, se ha observado que la vascularización es un proceso que se da de forma mucho más temprana en estadios del blastema, donde los vasos sanguíneos son derivados de células de vasos afectados por el daño en zonas mucho más proximales al muñón.[3]
En el momento de la amputación, los axones preexistentes en el muñón presentan una tendencia a contraerse en una distancia corta de forma proximal, antes de empezar el proceso de regeneración e inervar el estadio temprano del blastema y la epidermis superpuesta. Debido a que las células de los axones presentes en el blastema se encuentran dentro del sistema nervioso central, estas células no son consideradas células pertenecientes a ninguna de las poblaciones de células de blastema previamente mencionadas. Sin embargo, en el momento en el que los axones son contraídos debido al efecto de la amputación, dejan restos de tejido conectivo envolvente, compuesto por fibroblastos y células de Schawnn. Estas células proliferantes contribuyen de forma activa a la formación del blastema y, además, presentan asociaciones cercanas con los axones que están siendo regenerados, para formar nuevamente la envoltura de nervios en la extremidad.[3]
Por tanto, se puede concluir que la proliferación del blastema depende de la presencia de nervios, ya que las neuronas tienen la capacidad de liberar factores que incrementan la proliferación de las células del blastema.[1]
Tejidos esqueléticos
Los elementos esqueléticos que conforman el muñón dependen únicamente de la posición de la estructura. Esta conformación puede estar dada por el tejido conectivo (fibroblastos), o los condrocitos y células pericondriales u osteocitos, y las células perioestales. Sin embargo, el tejido conectivo es la estructura que mayor contribución presenta en la formación del blastema y su consecuente regeneración. En estudios realizados donde el tejido conectivo que rodea los elementos esqueléticos era eliminado, se observó un patrón de formación del blastema mucho menor que cuando éste se hallaba presente. Adicionalmente, se encontró evidencia de que el tejido esquelético de una extremidad amputada podía presentar formación de blastema y regeneración, a partir de únicamente elementos de fibroblasto, lo cual reafirmó la poca participación de elementos esqueléticos en el proceso de regeneración.[3]
Músculo
Debido a que el músculo presenta capas multicelulares con células de diferentes procedencias, el origen de las células progenitoras formadoras de blastema no está todavía claro. Las capas de tejido muscular son capas complejas, que poseen diversos tipos celulares, como las células de Schawnn asociadas a los nervios, miofibras, tejido conectivo o fibroblastos y células madres presentes en los músculos, que incluyen células satélites o células postsatelites. Existe evidencia de una línea celular denominada A1, capaz de formar miotubos in vitro. Estos miotubos multinucleados, al ser insertados en el blastema, reingresan en el ciclo celular al estimularlos con suero, y son fragmentados en células mononucleadas formadoras de blastema.[3]
Además de las células mononucleadas derivadas a partir de mioblastos multinucleados, las progenitoras de células postsatelite también contribuyen al proceso de regeneración muscular. Las células satélite son células madre miogénicas presentes debajo de la lámina externa de fibras musculares esqueléticas. Estas células responden a los daños mediante la incorporación de 3H-thimidina, y a la proliferación y fusión para formar miotubos, usando un mecanismo celular similar al de la línea A1. A pesar de la contribución relativa celular de las dos fuentes principales señaladas, es evidente que las células contribuyentes a la formación del blastema se encuentran presentes en los tejidos preexistentes de la estructura afectada.[3]
Tejido conectivo
Las células formadoras de tejido conectivo en la dermis y músculos proximales, nervios y vasos sanguíneos se denominan colectivamente fibroblastos. Los fibroblastos son los elementos celulares que mayor influencia presentan en la regeneración, tanto en términos de contribución celular en el momento de formar el blastema como en el control del crecimiento y del patrón de formación de la nueva estructura. La progenie de fibroblastos dérmicos conforma entre el 19 y el 78% de células en estadios tempranos de la formación de blastema.[3]
Proliferación
La proliferación de las células del blastema depende de la presencia de nervios, al ser las neuronas las encargadas de liberar factores que incrementan el potencial de proliferación. Uno de los factores liberados es el factor de crecimiento glial. Este factor es imperativo para mantener un grado alto de proliferación en las células del blastema. Otro factor importante es el factor de crecimiento fibroblastico 2 (FGF2), presente en los axones que inervan la extremidad, que efectúa una función crítica durante la proliferación. El FGF2 cumple funciones adicionales además de la regeneración. En primer lugar puede funcionar como un factor de angiogénesis, debido a que el tejido en regeneración necesita y desarrolla el suministro sanguíneo poco después de haberse generado un daño en el tejido. En segundo lugar, este factor actúa como un estimulante de la mitosis y establece el patrón de la extremidad en regeneración. Sin embargo, la proliferación de células del blastema no depende únicamente de los factores previamente mencionados. Esta proliferación requiere también efectos metabólicos excretados por las hormonas endocrinas, factores específicos derivados a partir del AEC, y los nervios presentes en la zona del blastema.[7]
Señales derivadas a partir de la epidermis apical
A pesar de que las células de la epidermis no poseen una contribución directa en la formación del blastema, el cubrimiento de células especializadas de la epidermis apical juega un papel crítico en el proceso de regeneración. Estas células permiten el crecimiento, y a su vez controlan el patrón de formación en el desarrollo de nuevas extremidades. Existe evidencia de que las alteraciones o la remoción de la WE o el AEC alteran el proceso de regeneración de forma dramática al interrumpir el contacto entre la epidermis apical y el muñón formador del blastema. La expresión de una serie de genes en células ubicadas en el muñón es una evidencia contundente de la interacción necesaria entre estas estructuras durante el mecanismo de regeneración. Debido a que la expresión de estos genes no se da en células adyacentes a puntos de contacto entre estas capas celulares, es presumible que la naturaleza de las señales tenga un rango de expresión corto y requiera una aproximación de las capas celulares involucradas.[3]
A pesar de que el mecanismo mediador de las señales expresadas en el muñón y la epidermis no esté claramente estipulado, se cree que los factores de crecimiento FGFs son importantes durante el proceso de regeneración. Muchos factores de crecimiento han demostrado expresividad en la regeneración, como es el caso de fgf4, fgf8 y fgf10. Estos factores están involucrados en los mecanismos de proliferación principalmente, pero se ha descubierto que también participan como quimioatrayentes y estimulantes de la migración de células del esbozo de las extremidades hacia la epidermis apical. Teniendo en cuenta que uno de los primeros eventos celulares en la regeneración es la migración de fibroblastos dérmicos y otras células distales del muñón hacia la WE, los FGFs podrían ser los responsable de emitir señales tempranas involucradas en eventos de migración temprana celular. Además, debido a que la proliferación precede a la migración, existe la hipótesis de que las tasas de proliferación dependan de la posición y del contacto celular originado a partir de la proximidad con la epidermis apical y las señales derivadas de la misma.[3]
Señales asociadas con el establecimiento de la punta distal
La evidencia molecular y genética indica que la especificación de la región distal es consecuencia de la expresión simultánea de los miembros 3' y 5' de los complejos Hox a y Hox d. La expresión temprana de los Hox a13 y Hox d9 en células del muñón sugiere que uno de los primeros eventos en la regeneración es el establecimiento de la punta distal, sin importar el nivel de amputación. El establecimiento temprano de la punta distal garantiza que los tejidos en regeneración sean siempre un reemplazo exacto de la porción del patrón que ha sido eliminado por la amputación. Adicionalmente, el blastema distal señaliza al muñón proximal, incentivando la proliferación y regeneración de las estructuras intermedias ausentes.[3]
Referencias
- Gilbert, Scott F. (2000). Swarthmore College, ed. Developmental biology [Biología de desarrollo] (en inglés) (6º edición). Maryland: Sinauer Associates. ISBN 0878932437. OCLC 43599090.
- Heber-Katz, Ellen, ed. (2004). Regeneration: Stem Cells and Beyond [Regeneración: Células madres y más] (en inglés). Springer. ISBN 978-3-642-62321-9. doi:10.1007/978-3-642-18846-6.
- Hall, Brian K., ed. (2007). Fins into Limbs: Evolution, Development, and Transformation [Aleta a extremidad: Evolución, desarrollo, y transformación] (en inglés). University of Chicago Press. ISBN 0226313409. OCLC 308649613.
- Nombela, César (2007). Células madre: Encrucijadas biológicas para la medicina: del tronco embrionario a la regeneración adulta. EDAF. ISBN 9788441418233. OCLC 123941218.
- Sánchez Alvarado, Alejandro (27 de enero de 2006). «Planarian regeneration: Its end is its beginning». Cell (en inglés) 124 (2): 241-245. ISSN 0092-8674. PMID 16439195. doi:10.1016/j.cell.2006.01.012.
- Agata, K.; Tanaka, T.; Kobayashi, C.; Kato, K.; Saitoh, Y. (febrero de 2003). «Intercalary regeneration in planarians». Developmental Dynamics (en inglés) 226 (2): 308-316. ISSN 1058-8388. PMID 12557208. doi:10.1002/dvdy.10249.
- Handberg-Thorsager, Mette; Fernandez, Enrique; Salo, Emili (1 de mayo de 2008). «Stem cells and regeneration in planarians». Frontiers in Bioscience (en inglés) 13: 6374-6394. ISSN 1093-9946. PMID 18508666.
Bibliografía
- Álvarez Díaz, J.A. (2007). «El estatus del embrión humano desde el gradualismo». Medigraphic 143 (3): 267-277.